Bài thói quen độ đậm đặc mol và độ đậm đặc dung dịch
Bài thói quen độ đậm đặc mol và độ đậm đặc phần trăm
- I. Nồng chừng Tỷ Lệ (C%)
- II. Nồng chừng mol (CM )
- Thực hành tính Nồng chừng Mol
Công thức tính độ đậm đặc mol và độ đậm đặc Tỷ Lệ được VnDoc biên soạn 2 công thức tính độ đậm đặc mol và độ đậm đặc hỗn hợp. Đây là 2 công thức điển hình nổi bật của Hóa học tập 8 được dùng trong số bài bác luyện hỗn hợp khi đề bài bác đòi hỏi tính độ đậm đặc mol và độ đậm đặc hỗn hợp. Tài liệu hỗ trợ cho những em kỹ năng cơ bạn dạng kèm cặp những bài bác luyện tương quan cho những em ôn luyện. Hy vọng tư liệu này sẽ hỗ trợ những em bao quát, ghi ghi nhớ một cơ hội đơn giản kể từ bại áp dụng hiệu suất cao vô những bài bác luyện.
Bạn đang xem: Công thức tính nồng độ mol và nồng độ phần trăm
- Tổng hợp ý công thức Hóa học tập 8 cần thiết nhớ
- Hoá học tập 8 Bài 42 Nồng chừng dung dịch
- Các bài bác luyện về lượng hóa học dư Hóa học tập 8
- Bài luyện ôn hè môn Hóa học tập lớp 8 lên lớp 9
NỒNG ĐỘ DUNG DỊCH
Bản quyền thuộc sở hữu VnDoc nghiêm ngặt cấm từng hành động sao chép vì thế mục tiêu thương mại
Thực hành tính Nồng chừng Mol
Cách thực hiện:
- Chọn Lượng hóa học tan
- Chọn Thể tích dung dịch
Lưu ý: Bạn hoàn toàn có thể lựa chọn Chất tan ở dù Drink mix
I. Nồng chừng Tỷ Lệ (C%)
Nồng chừng Tỷ Lệ của hỗn hợp là số gam hóa học tan đem vô 100 gam dung dịch
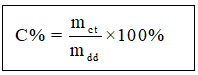
Trong đó:
mct là lượng hóa học tan
mdd là lượng dung dịch
mdd = mdm + mct
Ví dụ 1: Hòa tan 15 gam muối bột vô 50 gam nước. Tính độ đậm đặc Tỷ Lệ của hỗn hợp thu được:
Hướng dẫn giải cụ thể bài bác tập
Ta có: mdd = mdm + mct = 50 + 15 = 65 gam
Áp dụng công thức:
![]()
![]()
Ví dụ 2: Người tớ hòa tan 40 gam muối bột và nước được hỗn hợp đem độ đậm đặc 20%.
a) Tính lượng hỗn hợp nước muối bột chiếm được.
b) Tính lượng nước nhớ dùng cho việc điều chế bên trên.
Hướng dẫn giải cụ thể bài bác tập
a) Khối lượng hỗn hợp nước muối bột chiếm được là:
![]()
c) lượng nước nhớ dùng cho việc điều chế bên trên là:
mdd - mct = 200 - 40 = 160 gam
Ví dụ 3: Trộn 50 gam hỗn hợp muối bột ăn đem độ đậm đặc 20% với 50 gam hỗn hợp muối bột ăn 10%. Tính độ đậm đặc Tỷ Lệ của hỗn hợp thu được?
Hướng dẫn giải cụ thể bài bác tập
Số gam muối bột ăn đem vô 50 gam hỗn hợp muối bột ăn độ đậm đặc 20% là:
![]()
Số gam muối bột ăn đem vô 50 gam hỗn hợp muối bột ăn độ đậm đặc 10% là:
![]()
Dung dịch muối bột ăn chiếm được sau phản xạ là: mdd1 + mdd2 = 50 + 50 = 100 gam
Nồng chừng % hỗn hợp muối bột ăn sau khoản thời gian trộn là:

Ví dụ 4. Hòa tan 25 gam lối vô nước được hỗn hợp độ đậm đặc 50%
Hãy tính:
a) Khối lượng hỗn hợp lối điều chế được.
b) Khối lượng nước nhớ dùng cho việc điều chế.
Hướng dẫn giải cụ thể bài bác tập
Từ công thức m dd = (mct.100%)/C%
a. Khối lượng hỗn hợp lối điều chế được
mdd = (25.100)/50 = 50 (gam)
b. Khối lượng nước nhớ dùng cho việc trộn chế:
m dm = mdd - m đường = 50 -25 = 25 (gam)
Ví dụ 5. Hòa tan CaCO3 vô 200 gam hỗn hợp HCl 7,3% (vừa đủ)
a. Viết phương trình hóa học
b. Tính độ đậm đặc Tỷ Lệ của những hóa học đem vô hỗn hợp sau phản xạ.
Hướng dẫn giải cụ thể bài bác tập
Khối lượng của HCl đem vô 200 gam hỗn hợp HCl 7,3% là
mHCl = (C%.mdd)/100% = 200.7,3/100 = 14,6 (gam) => nHCl = 0,4 mol
Phương trình: CaCO3 + 2HCl → CaCl2 + H2O + CO2
nCaCO3 = nCaCl2 = nCO2 = 1/2nHCl = 0,2 mol -> mCaCO3 = trăng tròn gam
mCaCl2 = 0,2.111 = 22,2 gam
mCO2= 0,2.44 = 8,8 gam
Khối lượng hỗn hợp sau phản xạ là:
m dd sau phản ứng = mCaCO3 + mdd HCl - mCO2 = trăng tròn + 200 - 8,8 = 211,2 gam
Nồng chừng của CaCl2 là: C% dd CaCl2 = (22,3.100%)/(211.2) = 10,51%
Ví dụ 6. Tiến hành thí nghiệm cho 400 gam hỗn hợp NaOH 20% ứng dụng vừa vặn đầy đủ với 200 gam hỗn hợp HCl, phản xạ sinh đi ra NaCl và H2O. Tính độ đậm đặc muối bột sinh đi ra sau phản xạ.
Hướng dẫn giải cụ thể bài bác tập
Khối lượng NaOH là:
mNaOH = mdd.C%/100 = 400.20/100 = 80 gam
=> Số mol NaOH là: nNaOH = 80/40 = 3 mol
Phương trình chất hóa học phản ứng: NaOH + HCl → NaCl + H2O
Theo phương trình hóa học: 1mol → 1mol → 1mol
Muối chiếm được sau phản xạ là NaCl
mNaCl = 2.58,5 = 117 gam
Do phản xạ ko sinh đi ra hóa học khí hoặc kết tủa nên lượng hỗn hợp sau phản xạ là:
mdd sau pứ = mdd NaOH + mdd HCl = 400 + 200 = 600 (gam)
=> Nồng chừng dd NaCl sau phản xạ là: C%ddNaCl = 117/600.100% = 19,5 %
II. Nồng chừng mol (CM )
Nồng chừng mol của hỗn hợp cho biết thêm số mol hóa học tan đem trong một lít dung dịch
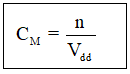
Trong đó: CM là độ đậm đặc mol
n là số mol hóa học tan
Vdd là thể tích hỗn hợp (lít)
Ví dụ 1: Tính độ đậm đặc mol của hỗn hợp khi 0,5 lit hỗn hợp CuSO4 chứa chấp 100 gam CuSO4
Hướng dẫn giải cụ thể bài bác tập
Số mol của CuSO4 = 100 : 160 = 0,625 mol
Nồng chừng mol của hỗn hợp CuSO4 = 0,625 : 0,5 = 1,25M
Ví dụ 2: Tính lượng H2SO4 đem vô 100 ml hỗn hợp H2SO4 2M
Hướng dẫn giải cụ thể bài bác tập
Số mol của H2SO4 là = 0,1 x 2 = 0,2 mol
Khối lượng của H2SO4 = 0,2 x 98 = 19,6 gam
Ví dụ 3: Trộn 200 ml hỗn hợp H2SO4 4M vô 4 lít hỗn hợp H2SO4 0,25M. Nồng chừng mol của hỗn hợp mới mẻ là
Hướng dẫn giải cụ thể bài bác tập
Số mol H2SO4 2 lít hỗn hợp H2SO4 4M là
0,2 : 4 = 0,8 mol
Số mol H2SO4 4 lít hỗn hợp H2SO4 0,25M là
4 : 0,25 = 1 mol
Thể tích sau khoản thời gian trộn hỗn hợp là: 4 + 0,2 = 4,2 lít
Nồng chừng mol của hỗn hợp mới mẻ là: ( 0,8 + 1) : 4,2 = 0,43M
Ví dụ 4. Cho 6,5 gam kẽm phản xạ vừa vặn đầy đủ với 100 mol hỗn hợp axit HCl
a. Tính thể tích H2 chiếm được ở ĐK chi tiêu chuẩn
b. Tính độ đậm đặc mol của hỗn hợp HCl đang được người sử dụng.
Hướng dẫn giải cụ thể bài bác tập
Số mol của Zn là: nZn = 6,5/65 = 0,1 mol
Phương trình hóa học: Zn + 2HCl → ZnCl2 + H2
nZn = nZnCl2 = 0,1 mol, nHCl = 2.nZn = 0,2 mol
a. VH2 = 0,1 . 22,4 = 2,24 (lít)
b. CM (dd HCl) = 0,2/0,1 = 2M
III. Bài luyện áp dụng liên quan
Câu 1: Trộn lộn 100 gam hỗn hợp H2SO4 10% với 200 gam hỗn hợp H2SO4 C% chiếm được hỗn hợp H2SO4 30%. Tính C%.
Hướng dẫn giải cụ thể bài bác tập
mddH2SO4.24,5% = 200 .1,12 = 224 (g)
⇒ mH2SO4.24,5% = 224 . 24,5% = 54,88 (g)
mH2SO4.10% = 26×10% = 2,6(g)
Ta có: mddH2SO4mới = 224 + 26 = 250(g)
mH2SO4mới = 54,88 + 2,6 = 57,48(g)
⇒C%H2SO4mới = 57,48/250×100% = 22,992%
Câu 2: Cho D = m/v. Lập công thức thể hiện nay quan hệ thân ái C% và CM.
Hướng dẫn giải cụ thể bài bác tập
Ta có: Lấy V lít hoặc 1000V ml dung dịch
=> Khối lượng hỗn hợp là: mdd = 100V. D
Khối lượng hóa học tan là: ![]()
Số mol của hóa học tan là: ![]()
Ta có:

Câu 3: Trong Cho m gam NaCl vô nước được 200 gam hỗn hợp NaCl 15%. Tính độ đậm đặc mol của dung dich NaCl. sành dung dich NaCl đem D= 1,1g/ml.
Hướng dẫn giải cụ thể bài bác tập
m NaCl = 200. 15/100= 30g
=> n NaCl = 0,5 mol
Vdd NaCl = mdd / D = 200/ 1,1 = 181,8 ml = 0,182 l
=> Nồng chừng mol = 0,5/ 0,182 = 2,75 (M)
Câu 4: Trộn 2 lít hỗn hợp lối 0,5M với 3 lit hỗn hợp lối 1M. Tính độ đậm đặc mol của hỗn hợp lối sau khoản thời gian trộn?
Hướng dẫn giải cụ thể bài bác tập
Tính số mol lối đem vô hỗn hợp 1:
n1 = CM 1.Vdd 1 = 0,5.2 = 1 mol
Tính số mol lối đem vô hỗn hợp 2:
n2 = CM 2.Vdd 2 = 1.3=3 mol
Tính số mol lối đem vô hỗn hợp 3:
n3 = n1 + n2 = 1+3 = 4 mol
Tính thể tích hỗn hợp 3
Xem thêm: Tải xuống – Google Drive
Vdd 3 = Vdd 1 + Vdd 2 = 2 + 3 = 5 lit
Tính độ đậm đặc mol hỗn hợp 3
CM = n : V = 4: 5 = 0,8 M
Câu 5: Tính độ đậm đặc mol của dung dịch
a. 1 mol KCl vô 750ml dung dịch
b. 0,5 mol MgCl2 trong một,5 lít dung dịch
c. 0,06 mol vô 1500 ml dung dịch
Hướng dẫn giải cụ thể bài bác tập
Đổi 750 ml = 0,75 lít
CM = 1/0,75 = 1,33 mol/l
b. CM = 0,5/1,5 = 0,33 mol/l
c. Đổi 1500 ml = 1,5 lít
CM = 0,06/1,5 = 0,04 mol/l
Câu 6: Tính độ đậm đặc Tỷ Lệ của những hỗn hợp sau
a. trăng tròn gam KCl vô 600 gam dung dịch
b. 32 gam KNO3 vô 2 Kg dung dịch
c. 75 g K2CO3 vô 1500 gam dung dịch
Hướng dẫn giải cụ thể bài bác tập
a) C%KCl = mct/mdd.100 = 20/600.100 = 10/3 ≈ 3,33%
b) Đổi: 2kg = 2000 g
C%NaNO3 = 32/2000.100 = 1,6%
c)C%K2SO4 = 75/1500.100 = 5%
Câu 7: Đun nhẹ nhàng trăng tròn gam hỗn hợp CuSO4 cho tới khi nước cất cánh khá không còn chiếm được 3,6 gam hóa học rắn. Xác toan độ đậm đặc Tỷ Lệ của hỗn hợp CuSO4.
Hướng dẫn giải cụ thể bài bác tập
CuSO4 khan là hóa học tan.
Nồng chừng Tỷ Lệ của hỗn hợp CuSO4 là:
C% = 3,6/20.100 = 18%
Vậy: Nồng chừng Tỷ Lệ của hỗn hợp CuSO4 bên trên là 18%
Câu 8: Trung hòa 30ml hỗn hợp H2SO4 1m cần thiết dung 50 ml hỗn hợp NaOH:
a) Viết phương trình hóa học
b) Tính độ đậm đặc hỗn hợp NaOH đang được dùng
c) Nếu dung hòa hỗn hợp H2SO4 ở bên trên vị hỗn hợp KOH 5,6% đem lượng riêng rẽ 1,045g/ml thì nên cần từng nào ml KOH
Hướng dẫn giải cụ thể bài bác tập
Phương trình hóa học
a) 2NaOH + H2SO4 → Na2SO4 + 2H2O
b)
nH2SO4 = 0,03.1 = 0,03 (mol)
nNaOH = 2nH2SO4 = 0,06 (mol)
=> CMNaOH = 0,06/0,05 = 1,2M
c) H2SO4 + 2KOH → K2SO4 + 2H2O
nKOH = 2nH2SO4 = 0,06 (mol)
=> mKOH = 0,06.56 = 3,36 gam
=> mddKOH = 3,36/5,6% = 60 (gam)
=> V hỗn hợp KOH = m/D = 60/1,045 = 57,42 (ml)
Câu 9: Cho từng nào gam NaOH vô từng nào gam nước đem vô 200 gam hỗn hợp NaOH 10%.
Hướng dẫn giải cụ thể bài bác tập
Khối lượng NaOH là:
mNaOH = 10.200/100 = trăng tròn (g)
Khối lượng nước nhớ dùng là:
mH2O = mdd − mNaOH = 200 − trăng tròn = 180 (g)
Câu 10: Tính
a. Khối lượng nước đem vô 400 gam hỗn hợp CuSO4 4%
b. Khối lượng NaCl đem vô 300ml hỗn hợp NaCl 3M
Hướng dẫn giải cụ thể bài bác tập
a) nCuSO4 = 400.4/100 = 16 gam
mH2O = 400 - 16 = 384 g.
b)
Vì đơn vị chức năng của độ đậm đặc mol là mol/l nên tớ thay đổi 300 ml trở thành 0,3 lít
Số mol hóa học tan vô 0,3 lít hỗn hợp NaCl 3M là
CM = nV => n = CM.V = 3.0,3 = 0,9mol
Khối lượng NaCl cần thiết lấy là: mNaCl = n.M = 0,9.58,5 = 52,65 gam
Câu 11: Cho 6,5 gam kẽm phản xạ vừa vặn đầy đủ với 100 ml hỗn hợp axit clohiđric.
a. Tính thể tích khí hiđro chiếm được ở đktc?
b. Tính độ đậm đặc mol của hỗn hợp muối bột chiếm được sau phản ứng?
c. Tính độ đậm đặc mol của hỗn hợp axit HCl đang được dùng?
Hướng dẫn giải cụ thể bài bác tập
nZn = m/M = 6,5/ 65 = 0,1 (mol)
Phương trình hóa học: Zn + 2HCl → ZnCl2 + H2 ↑
Theo phương trình 1 2 1 1(mol)
Phản ứng: 0,1 0,2 0,1 0,1 (mol)
a.
VH2 = n.22,4 = 0,1.22,4 = 2,24 (l)
b. Ta đem nZnCl2 = nH2 = 0,1 mol => CM ZnCl2 = 0,1/0,2 = 0,5M
c. CMddHCl = n/V= 0,1/0,2 = 0,5 (M)
Câu 12: Cho 25 gam hỗn hợp NaOH 4% ứng dụng vừa vặn đầy đủ ứng dụng với 51 gam hỗn hợp H2SO4 0,2M (có thể tích 52 ml). Tính độ đậm đặc % những hóa học vô hỗn hợp sau phản ứng?
Hướng dẫn giải cụ thể bài bác tập
mNaOH = 25.4% =1 gam
=> nNaOH = 1/40 = 0,025 mol
nH2SO4 = 0,2.52/1000 = 0,0104 mol
Phương trình phản ứng
2NaOH + H2SO4 → Na2SO4 + 2H2O
Ban đầu: 0,025 mol
Phản ứng: 0,0208 mol ← 0,0104 mol → 0,0104 mol
Sau pứ: 4,2.10-3 mol
mNaOH dư =4,2.10-3.40 = 0,168 gam
mNa2SO4 = 0,0104.142 = 1,4768 gam
mdd sau pứ = 25 + 51 = 76 gam
C%dd NaOH dư = 0,168/76.100% = 0,22%
C%dd Na2SO4 = 1,4768/76.100% = 1,943%
Câu 13: Hòa tan 6 gam magie oxit (MgO) vô 50 ml hỗn hợp H2SO4 (có d = 1,2 g/ml) vừa vặn đầy đủ.
a. Tính lượng axit H2SO4 đang được phản ứng?
b. Tính độ đậm đặc % của hỗn hợp H2SO4 axit trên?
c. Tính độ đậm đặc % của hỗn hợp muối bột sau phản ứng?
Đáp án chỉ dẫn giải chi tiết
a) nMgO = 6:40 =0,15 (mol)
Ta đem phương trình hóa học
MgO + H2SO4 → MgSO4 + H2O
0,15......0,15...........0,15..................(mol)
Theo phương trình hóa học: mH2SO4 = 0,15.98 = 14,7g
b)Ta có: mdd H2SO4 = D.V=1,2.50 = 60 (g)
=> Nồng chừng % dd H2SO4 là:
C%dd H2SO4 =14,760.100%=24,5%
c)Theo phương trình hóa học: mMgSO4 = 0,15.120=18(g)
Khối lượng dd sau pư là:
mddsau = mMgO + mddH2SO4 = 6 + 60 = 66 (g)
Câu 14: Cho 200 gam hỗn hợp NaOH 4% ứng dụng vừa vặn đầy đủ với hỗn hợp axit H2SO4 0,2M.
a. Tính thể tích hỗn hợp axit cần thiết dùng?
b. sành lượng của hỗn hợp axit bên trên là 510 gam. Tính độ đậm đặc % của hóa học đem vô hỗn hợp sau phản ứng?
Đáp án chỉ dẫn giải chi tiết
a) Phương trình phản xạ hóa học
2NaOH + H2SO4 → Na2SO4 + 2H2O
nNaOH = (200.4%) /40 = 0,2 (mol)
⇒nH2SO4 = 0,2 : 2 =0,1 (mol) (Theo tỉ trọng 2:12:1 )
⇒ VH2SO4 =n/CM = 0,1/0,2 = 0,5l = 500ml
b) Ta đang được có:
nNaOH = 0,2 (mol)
⇒ nNa2SO4= 0,2/2 =0,1(mol) (Theo tỉ trọng 2:12:1 )
⇒mddsaupư = 510 + 200 = 710 (g)
⇒C%Na2SO4 = (0,1.142)/710.100% = 2%
.....................
+ Thứ nhất tính số mol của NaOH tiếp sau đó tính được số mol của H2SO4
+ Tính được V H2SO4 kể từ số mol của H2SO4 và độ đậm đặc mol H2SO4
+ Sau bại tính được số mol của Na2SO4 và lượng hỗn hợp sau pư roii tớ tính được C%
Câu 15: Cho 10,8 gam FeO ứng dụng vừa vặn đầy đủ với 100 gam hỗn hợp axit clohiđric.
a. Tính lượng axit đang được người sử dụng, kể từ bại suy đi ra độ đậm đặc % của hỗn hợp axit?
b. Tính độ đậm đặc % của hỗn hợp muối bột chiếm được sau phản ứng?
................................................
Xem thêm: Vé máy bay Tết Vietjet 2024 giá rẻ nhất, nhiều khuyến mãi - Traveloka.com
VnDoc đang được reviews Công thức tính độ đậm đặc mol và độ đậm đặc Tỷ Lệ, là 2 công thức đo lường và tính toán được vận dụng cho những dạng bài bác luyện Hóa học tập 8 cũng tựa như các lớp bên trên. Khi bài bác luyện đòi hỏi tính độ đậm đặc mol hoặc độ đậm đặc hỗn hợp thì những em tiếp tục biết phương pháp dùng linh động công thức vô thực hiện bài bác luyện. Hy vong tư liệu này sẽ hỗ trợ những em gia tăng, rèn luyện bài bác thói quen toán độ đậm đặc hỗn hợp tương đương học tập đảm bảo chất lượng môn Hóa học tập rộng lớn.
Trên trên đây VnDoc đã lấy cho tới chúng ta một tư liệu vô cùng hữu ích Công thức tính độ đậm đặc mol và công thức tính độ đậm đặc Tỷ Lệ. Để đem sản phẩm tiếp thu kiến thức đảm bảo chất lượng rộng lớn, VnDoc nài reviews cho tới chúng ta học viên tư liệu Giải bài bác luyện Hóa học tập 8; Chuyên đề Hóa học tập 8; Trắc nghiệm Hóa Học 8 online nhưng mà VnDoc tổ hợp biên soạn và đăng lên.
Ngoài đi ra, VnDoc.com đang được xây dựng group share tư liệu tiếp thu kiến thức trung học cơ sở không lấy phí bên trên Facebook: Tài liệu tiếp thu kiến thức lớp 8. Mời chúng ta học viên nhập cuộc group, nhằm hoàn toàn có thể sẽ có được những tư liệu tiên tiến nhất.







Bình luận